Cluster-Anionen der Gruppen 14 und 15
Homoatomare Anionen der Hauptgruppenelemente sind zu Recht beliebte Untersuchungsobjekte der Grundlagenforschung, an ihnen können Verknüpfungsmuster der Elemente und fundamentale Aspekte unpolarer chemischer Bindungen besonders gut studiert werden. Sie sind jedoch auch interessante präparative Bausteine, in denen Element-Cluster "nackt", d.h. ohne Substituenten zur Verfügung stehen. Diese Bausteine können zur Erschließung neuer elementnaher Verbindungsklassen eingesetzt werden, bis hin zur Herstellung neuer Element-Modifikationen.
Solvatation und Umsetzung molekularer Cluster-Anionen
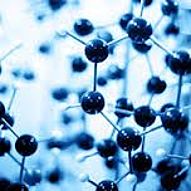
Viele Polyanionen sind in Festkörperverbindungen mit Alkalimetall-Gegenionen bereits vorgebildet. Sie können in flüssigem Ammoniak oft unverändert herausgelöst werden. In jüngster Zeit gelang so z.B. die Synthese des ersten Übergangsmetallkomplexes (Abb.1) eines Polysilicid-Anions mit aus K₆Rb₆Si₁₇ gewonnenen Si₉⁴⁻-Teilchen.
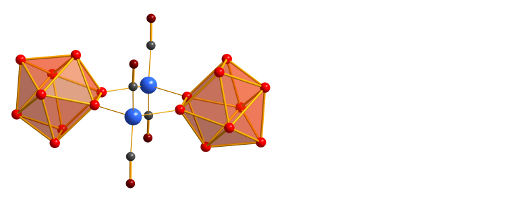
Abb.1: Erster Polysilicid-Übergangsmetallkomplex [{Ni(CO)₂}₂(µ-Si₉)₂]⁸⁻.
Synthese neuer Zintl-Anionen
Aus Festkörpern herausgelöste Polyanionen der schwereren Hauptgruppen-Elemente, die nach dem Pionier auf diesem Gebiet oft Zintl-Ionen genannt werden, können oxidativ zu neuen, größeren Teilchen verknüpft werden. Ein Beispiel dafür ist die Synthese von As₁₄⁴⁻ aus zwei As₇³⁻. Neue Zintl-Anionen entstehen aber auch durch die direkte Reduktion von Elementen oder Elementverbindungen mit Lösungen der Alkalimetalle in flüssigem Ammoniak, wie z.B. das ringförmige Sb₅⁵⁻ durch die Reduktion von Antimon mit Lithium oder das aromatische P₄²⁻ durch die Umsetzung von Diphosphan mit Cäsium.
Abb.2: Dimeres Zintl-Ion As₁₄⁴⁻ (links). Sb₅⁵⁻ im Ionenkomplex [Li₂(NH₃)₂Sb₅]³⁻ (rechts).
Quantenchemische Aspekte und ELF-Analyse
Die besondere Bindungssituation in Elektronenmangel-Teilchen wie Si₉⁴⁻ oder ungesättigten Anionen wie P₄²⁻ oder P₆⁴⁻ kann mit Hilfe der Elektronenlokalisierungsfunktion ELF (Abb.3) visualisiert werden. Für die von uns erstmals hergestellten Nicht-Kohlenstoff-Aromaten P₄²⁻ und As₄²⁻ haben wir den Begriff "Aromatizität der freien Elektronenpaare" vorgeschlagen, da sich das Bindungssystem grundsätzlich von jenem der Kohlenstoff-Aromaten wie z.B. Benzol unterscheidet.

Abb.3: Isoflächen der ELF von Si₉⁴⁻ (links) und P₄²⁻ (rechts).